Naturstoffgenomik
Identifizierung und funktionale Untersuchung mikrobieller Naturstoffe
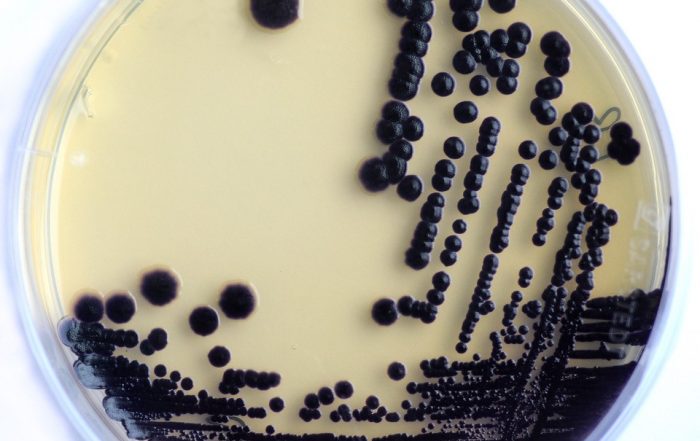
Foto: Dr. Carsten Kegler
Institution: Goethe-Universität Frankfurt
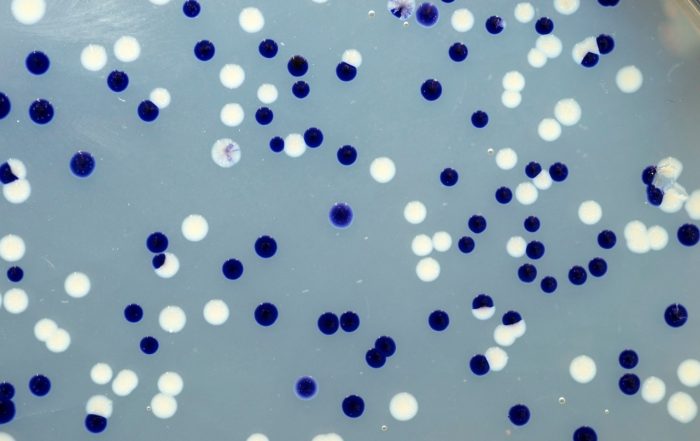
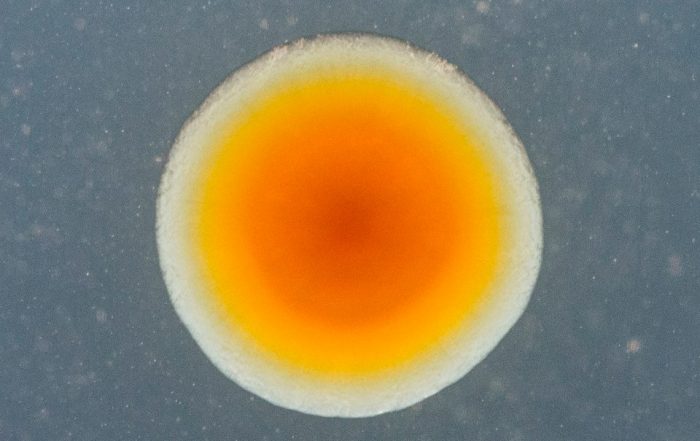
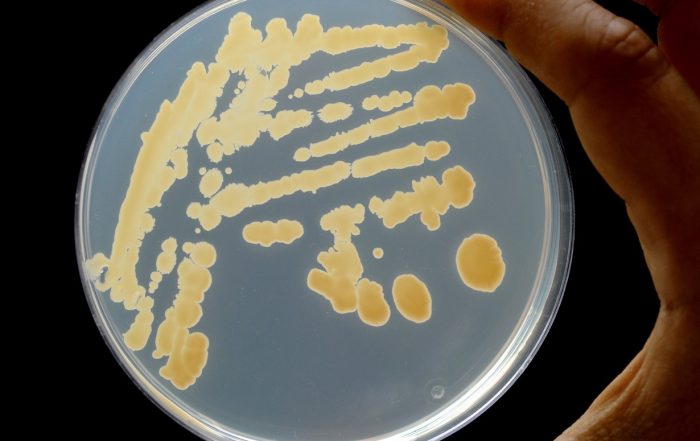
Zahlreiche klinisch eingesetzte Medikamente wie Antibiotika oder krebshemmende und immunsuppressive Wirkstoffe werden von Bakterien als Naturstoffe oder Sekundärmetaboliten (SMs) produziert. Obwohl diese SMs für unser Gesundheitssystem wichtig sind, wissen wir kaum, wie die Bakterien sie produzieren oder welche weiteren mikrobiellen SMs noch identifiziert und klinisch angewendet werden könnten.
Der Fokus unseres Projekts liegt auf der Entwicklung molekularer Methoden mit dem Ziel, neuartige SMs schneller identifizieren zu können. Zudem sollen beteiligte biosynthetische Gencluster (BGCs) so manipulieren werden, dass sie neuartige Derivate aus diesen SMs produzieren. Ein weiteres Ziel ist es, die Prozesse zu verstehen, die die SM-Produktion in Bakterien beeinflussen. Die Arbeit mit bakteriellen Genomen ist insbesondere im Hinblick auf den translationalen Aspekt von TBG wichtig, denn nur sie ermöglichen es uns, Manipulationen im gewünschten Ausmaß vorzunehmen.
Fotos: Dr. Carsten Kegler
EXPERTISE / METHODEN
- Identifizierung und Strukturaufklärung von Naturstoffen
- Manipulation von bakteriellen Genomen
- Massenspektrometrie
- Biochemie
- molekulare Mikrobiologie
ANALYSIERTE GENOME / ORGANISMEN
- Photorhabdus
- Xenorhabdus
- Pseudomonas
- Nematoden
- mit Insekten assoziierte Bakterien
TBG PROJEKT-TEAM
- Prof. Dr. Helge Bode
- Jürgen Breitenbach, Postdoc
- Edna Bode, Postdoc
- Carsten Kegler, Postdoc
- Kenan Bozhüyük, Postdoc
- Peter Grün, TA
- Timo Obermeier, PhD student
- Leonard Präve, PhD student
PUBLIkationen
Machado, R.A.R., Thönen, L., Arce, C.C.M. et al. Engineering bacterial symbionts of nematodes improves their biocontrol potential to counter the western corn rootworm. Nat Biotechnol 38, 600–608 (2020). https://doi.org/10.1038/s41587-020-0419-1
Bode E, Heinrich AK, Hirschmann M, Abebew D, Shi YN, Vo TD, Wesche F, Shi YM, Grün P, Simonyi S, Keller N, Engel Y, Wenski S, Bennet R, Beyer S, Bischoff I, Buaya A, Brandt S, Cakmak I, Çimen H, Eckstein S, Frank D, Fürst R, Gand M, Geisslinger G, Hazir S, Henke M, Heermann R, Lecaudey V, Schäfer W, Schiffmann S, Schüffler A, Schwenk R, Skaljac M, Thines M, Thines E, Ulshöfer T, Vilcinskas A, Wichelhaus TA, Bode HB, Promoter activation in hfq mutants as an efficient tool for specialized metabolite production enabling direct bioactivity testing. Angew Chem Int Ed 2019, 58 (52), 18957-18963. VIP paper. https://doi.org/10.1002/anie.201910563
Berry, D., Mace, W., Grage, K., Wesche, F., Gore, S., Schardl, C., Young, C., Dijkwel, P., Leuchtmann, A., Bode, H., and Scott, B. Efficient nonenzymatic cyclization and domain shuffling drive pyrrolopyrazine diversity from truncated variants of a fungal NRPS. PNAS 116 (51) 25614-25623 (2019). https://doi.org/10.1073/pnas.1913080116
Wang, G., Zhao, Z., Ke, J. et al. CRAGE enables rapid activation of biosynthetic gene clusters in undomesticated bacteria. Nat Microbiol 4, 2498–2510 (2019). https://doi.org/10.1038/s41564-019-0573-8
Schmidt, R., Ulanova, D., Wick, L.Y. et al. Microbe-driven chemical ecology: past, present and future. ISME J 13, 2656–2663 (2019). https://doi.org/10.1038/s41396-019-0469-x
Shi, Y., Pusch, S., Shi, Y., Richter, C., Maciá-Vicente, J., Schwalbe, H., Kaiser, M., Opatz, T., and Bode, H. (±)-Alternarlactones A and B, Two Antiparasitic Alternariol-like Dimers from the Fungus Alternaria alternata P1210 Isolated from the Halophyte Salicornia sp., The Journal of Organic Chemistry 2019 84 (17), 11203-11209. https://doi.org/10.1021/acs.joc.9b01229
Bozhüyük KAJ, Linck A, Tietze A, Kranz J, Wesche F, Nowak S, Fleischhacker F, Shi YN, Grün P, Bode HB, Modification and de novo design of non-ribosomal peptide synthetases using specific assembly points within condensation domains. Nat Chem. 2019 11(7): 653-661. https://doi.org/10.1038/s41557-019-0276-z